癫痫是一种由于脑部神经元异常过度放电引起的反复性、发作性和短暂性发作的慢性脑部疾病,欧博娱乐给患者及其家属带来了极大的社会和心理负担。据世界卫生组织(WHO)统计,癫痫全球发病率约为0.7-1%;国内流行病学资料显示,我国约有900万癫痫患者[1, 2]。因此,癫痫不仅仅是医疗问题,也是重要的公共卫生和社会问题。尽管目前有多种抗发作药物被临床应用于控制癫痫发作,但是均无法根治或预防癫痫,且不良反应明显;另外,约有三分之一的癫痫患者对多种抗发作药物耐受而发展为难治性癫痫[3]。此外,手术切除致癫痫病灶作为耐药病人常用的治疗手段,由于致痫病灶定位在关键的功能脑区或广泛分布等局限性,仅适用于一小部分患者。即使在手术成功后,癫痫患者的复发和不良反应仍然存在[4, 5]。这些反映了亟需寻找新的替代疗法来克服当前治疗策略的局限性。
中医治疗素有“天人相应”理念。《黄帝内经·素问·异法方宜论》黄帝曰:医之治病也,一病而治各不同,皆愈,何也?岐伯对曰:地势使然也。上述对话反映古代中医理论中注重地理环境对人体健康影响的思想,以及因地域不同而采取相异治疗方法的原则。现代医学研究也证实环境因素会多维度影响生命健康的各方面。丰富环境(EE)是一种包括运动、社交互动和情感参与的多感官刺激的无创治疗方法[6-8]。研究表明,它对大脑发育、认知功能[9, 10]具有积极影响以及在各种神经系统疾病中发挥神经保护作用[9, 11, 12]。近年来,EE作为一种有前途的非侵入性治疗方法来改善癫痫发作而受到越来越多的关注。早在1999年,在动物模型中就首次报道了EE对癫痫发作的抑制作用,研究表明在kainic acid(KA)诱导的癫痫模型中,与标准饲养条件下的大鼠相比,在EE治疗下的大鼠癫痫发作频率较低[13]。随后,陆续有研究证实了EE在多种不同动物癫痫模型中的癫痫治疗作用。例如匹罗卡品诱导的癫痫持续状态(SE)[7],杏仁核点燃模型[14],戊四唑(PTZ)诱导的癫痫发作模型[15]和遗传模型[16-18]。然而,尽管EE作为一种无创的治疗方法有着广阔的应用前景,欧博allbet但它在癫痫治疗中的确切机制仍未完全阐明。
2024年10月22日,浙江中医药大学汪仪研究员/陈忠教授团队在国际知名期刊《Advanced Science》发表了题为“Enriched environment reduces seizure susceptibility via entorhinal cortex circuit augmented adult neurogenesis”的研究论文。研究人员利用光/化学遗传学调控、免疫组织化学、病毒示踪、在体光纤记录、药理学等多种手段,首次发现EE通过激活内嗅皮层-海马齿状回(EC-DG)的谷氨酸能神经环路促进海马成体神经再生(AHN),促进有抗癫痫作用的海马新生颗粒细胞(abDGCs)的产生,从而发挥抗癫痫作用。研究为EE影响癫痫的环路机制提供了直接实验证据,同时,本研究也进一步揭示了EE状态下产生的abDGCs在癫痫中的作用,结合本团队前期工作癫痫不同阶段abDGCs的功能作用(Chen et al. STTT,2023)的基础上,为abDGCs在癫痫中的异质性提供了进一步证据。研究有望为未来的癫痫治疗提供了潜在新策略、新靶点,为EE在癫痫治疗中的临床转化奠定基础。(拓展阅读:陈忠课题组相关研究进展,详见“逻辑神经科学”报道:本文末【特别专栏】)

首先,研究者们使用免疫组织化学对增殖细胞标记物BrdU以及未成熟神经元标记物DCX进行染色来验证EE对小鼠AHN的影响。结果表明,与对照组相比,EE后BrdU+细胞、DCX+细胞和BrdU+ DCX+共定位的细胞数量均显著增加(图1A-E);提示EE对AHN有促进作用。为了验证EE对癫痫的保护作用,研究人员采用PTZ诱导的癫痫发作模型进行实验,发现EE能够降低小鼠对PTZ诱导的癫痫发作的易感性,发挥癫痫保护作用(图1F-K)。综上所述,EE不仅促进AHN,还同时降低了癫痫发作的易感性。
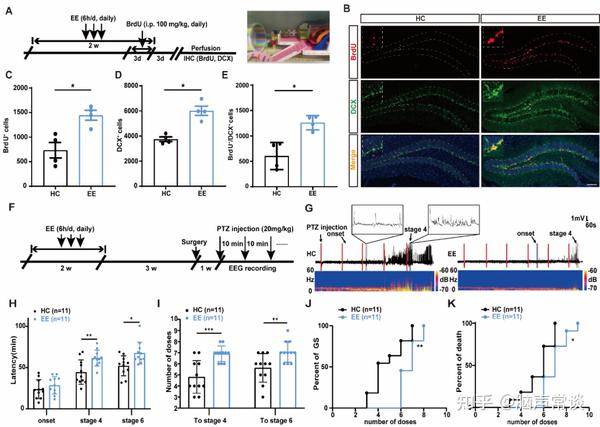
图1 EE促进AHN并降低癫痫发作易感性(图源:Li, et al., Adv Sci, 2024)
为了研究abDGCs是否直接参与EE的癫痫保护作用,研究人员利用在体钙信号光纤记录的方法来实时监测 PTZ 诱导的癫痫发作时abDGCs的钙活动变化。结果证明,癫痫起始后abDGCs的GCaMP6m荧光信号显著增加且在发作结束后立即下降(图2A-D)。综上,abDGCs钙活动在癫痫发作时大量增加,提示abDGCs确实参与了癫痫发作且在发作中功能受到激活。
为了进一步明确abDGCs具体如何参与癫痫发作,研究者们首先应用化学遗传学手段对abDGCs进行了选择性激活。结果发现,在PTZ诱导的癫痫模型中,化学遗传学激活abDGCs显著延长了小鼠第一次癫痫样放电以及达到全身性癫痫发作(4级和6级)的潜时及所需的 PTZ 剂量数(20 mg/次),并增加了小鼠死亡所需的PTZ剂量数(图2E-J),说明化学遗传学激活abDGCs能降低小鼠对PTZ诱导的癫痫发作的易感性。

图2 化学遗传学激活abDGCs降低癫痫发作易感性(图源:Li, et al., Adv Sci, 2024)
接下来,为了探究EE在PTZ诱导的癫痫模型中发挥的保护作用是否可能是通过介导abDGCs产生的,研究人员在PTZ诱导的癫痫模型中使用化学遗传学策略来沉默在EE治疗中产生的abDGCs。结果表明,EE后的小鼠癫痫发作易感性降低,而这些作用在抑制abDGCs后被逆转(图3)。提示abDGCs是EE降低小鼠癫痫发作易感性的必要条件。

图3 化学遗传学抑制 abDGCs逆转EE降低癫痫易感性的治疗作用(图源:Li, et al., Adv Sci, 2024)
为了进一步阐明EE促进AHN的神经环路机制,研究人员首先通过免疫组织化学技术进行全脑即刻早期基因c-Fos荧光标记实验来初步明确响应EE的脑区。研究主要统计了AHN所在DG的主要上游输入,发现EC是激活比例最高的脑区(图4A-D)。为了进一步验证这一结果,研究人员在EE后通过逆行示踪(CTB555)标记向DG投射的神经元,结果发现向DG投射的EC神经元被大量激活且主要为CaMKIIα阳性神经元(图4E-H),提示EE可以激活EC-DG的谷氨酸能神经投射。进一步,研究者们通过钙信号光纤记录的方法来实时监测投射到DG的EC CaMKIIα+神经元在 EE中的钙活动变化,结果也表明投射到DG的EC CaMKIIα+神经元在EE中被激活(图4I-M),提示它们可能参与介导EE对AHN的调控。
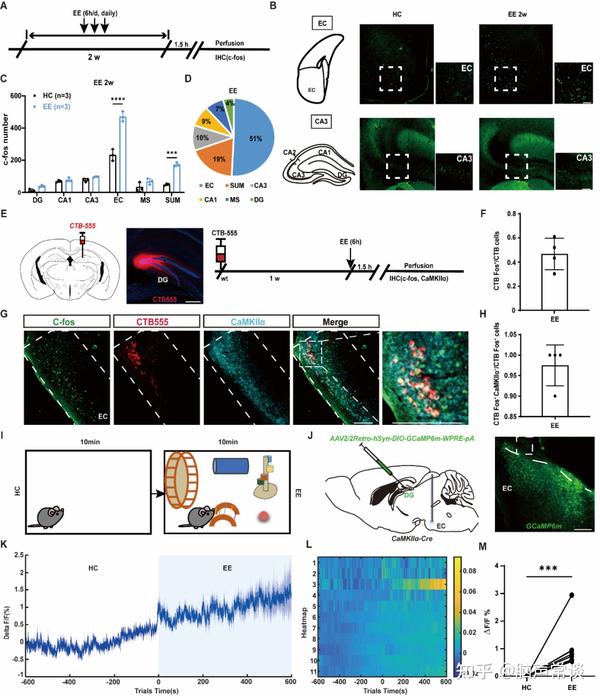
图4 EE增加向DG投射的EC CaMKII+神经元的神经兴奋性(图源:Li, et al., Adv Sci, 2024)
接下来,为了探究慢性激活EC CaMKIIα+神经元是否可以模拟EE对AHN的促进作用,研究人员发现慢性模式光遗传学手段特异性激活EC CaMKIIα+神经元可以促进AHN的增殖并使其更加成熟(图5A-I)。相反,进一步使用化学遗传学方法来特异性抑制EC CaMKIIα+神经元,研究结果显示化学遗传抑制EC CaMKIIα+神经元抑制了AHN的增殖(图5J-O)。进一步的顺向跨单突触病毒环路示踪及药理学干预发现,EC-DG谷氨酸能神经投射可以直接与DG的多种细胞类型存在结构连接,其增加AHN由兴奋性传递与抑制性传递共同介导实现。综上所述, EC CaMKIIα+神经元能够双向调节AHN。值得注意的是,EC神经元的慢性模式激活可以模拟EE对EC CaMKIIα神经元的功能性激活以及对AHN的促进作用。

图5 慢性模式光/化学遗传学激活或抑制EC CaMKII+神经元双向调节AHN(图源:Li, et al., Adv Sci, 2024)
此外,研究人员为了探究ECCaMKIIα-DG神经环路是否是EE发挥促进AHN作用和抗癫痫作用所必要的,通过在EE治疗的同时利用化学遗传学选择性抑制EC CaMKIIα+神经元,发现EE诱导的AHN促进作用以及抗癫痫作用在化学遗传学抑制EC CaMKIIα+神经元后被逆转(图6)。这些结果提示,ECCaMKIIα-DG神经环路对于EE发挥促进AHN作用以及抗癫痫作用是必要的。
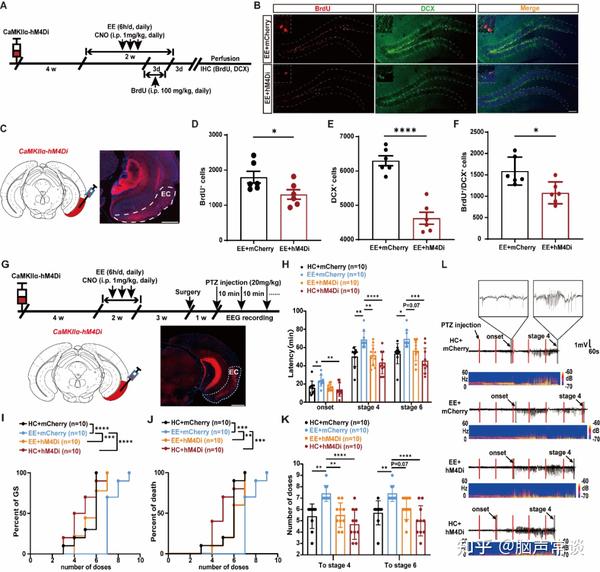
图6 抑制EC CaMKII+神经元逆转EE促进AHN以及降低癫痫发作易感性的治疗作用(图源:Li, et al., Adv Sci, 2024)
传统癫痫发病理论认为“兴奋-抑制失衡”是癫痫发作的主要机制。GABA能中间神经元被认为是主要的抑制性神经元;抑制其功能或直接杀死可能直接诱导癫痫形成,而GABA 能中间神经元的光遗传学选择性激活则被报道能够抑制癫痫[19, 20]。此外,前期研究表明 abDGCs能够通过苔藓纤维与DG/门区的GABA能中间神经元形成直接突触联系[21-24]。研究人员推测兴奋性的abDGCs可能通过介导DG局部的GABA能中间神经元发挥其抗癫痫作用。为了验证这一假设,研究人员利用钙信号光纤记录,发现光遗传学激活abDGCs的显著增加了局部GABA能中间神经元的钙活动水平(图7A-F),提示abDGCs和GABA能中间神经元之间的确存在兴奋性联系。此外,GABA能中间神经元的化学遗传学激活降低了癫痫发作易感性(图7G-L),这类似于EE的抗癫痫作用。总之,这些结果表明 abDGCs和邻近的GABA能神经元之间的功能联系,为在EE治疗产生的abDGCs的“保护”作用提供了潜在的环路基础。

图7 abDGCs招募DG局部GABA能神经元发挥抗癫痫作用(图源:Li, et al., Adv Sci, 2024)
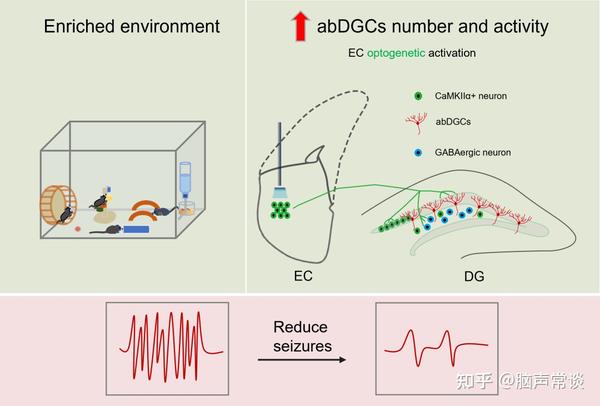
Graphical abstract(图源:Li, et al., Adv Sci, 2024)
文章结论与讨论,启发与展望
综上所述,本研究拟利用小鼠戊四唑(PTZ)诱导的癫痫发作模型,结合光/化学遗传学调控、免疫组织化学、病毒示踪、在体光纤记录、药理学等多种手段,EE主要通过慢性激活内嗅皮层-海马齿状回的谷氨酸能神经环路从而促进abDGCs,而abDGCs则通过增强海马齿状回的“门控”抑制性中间神经元发挥抗癫痫作用。本研究为EE影响癫痫发作易感性的机制提供了实验证据,也为丰富中医“天人相应”理念中的环境因素影响疾病的理论提供佐证。
EE作为一种非药物和非侵入性的治疗手段,在临床转化中具有巨大的潜力,不仅可以单独使用用于癫痫预防,还有望与当前的抗发作药物协同使用实现“减量增效”。深入解析其作用机制,有助于进一步优化EE处理的模式,从而为其更好的临床转化奠定基础。此外,本研究发现EC-DG谷氨酸能神经环路增加AHN由兴奋性传递与抑制性传递共同介导实现,在未来的研究中寻找能特异性精确调控癫痫不同阶段的AHN水平或abDGCs功能活性的可能成药的分子靶点,可能为癫痫治疗提供新思路、新策略。
阅读原文
参考文献
[1] O. Devinsky, A. Vezzani, T.J. O'Brien, N. Jette, I.E. Scheffer, M. de Curtis, P. Perucca, Epilepsy, Nat Rev Dis Primers 4 (2018) 18024.
[2] R.D. Thijs, R. Surges, T.J. O'Brien, J.W. Sander, Epilepsy in adults, The Lancet 393(10172) (2019) 689-701.
[3] O. Devinsky, A. Vezzani, T.J. O'Brien, N. Jette, I.E. Scheffer, M. de Curtis, P. Perucca, Epilepsy, Nature Reviews. Disease Primers 4 (2018) 18024.
[4] N. Jetté, J.W. Sander, M.R. Keezer, Surgical treatment for epilepsy: the potential gap between evidence and practice, The Lancet Neurology 15(9) (2016) 982-994.
[5] J. Chen, Z. Li, L. Chen, Reactive glia-to-GABAergic neuron reprogramming: a “golden touch” strategy to alleviate intractable seizures, Acta Epileptologica 4(1) (2022) 35.
[6] G. Kempermann, H.G. Kuhn, F.H. Gage, More hippocampal neurons in adult mice living in an enriched environment, Nature 386(6624) (1997) 493-5.
[7] M. Vrinda, A. Sasidharan, S. Aparna, B.N. Srikumar, B.M. Kutty, B.S. Shankaranarayana Rao, Enriched environment attenuates behavioral seizuresand depression in chronic temporal lobe epilepsy, Epilepsia 58(7) (2017) 1148-1158.
[8] V.R. Gorantla, S.E. Thomas, R.M. Millis, Environmental Enrichment and Brain Neuroplasticity in the Kainate Rat Model of Temporal Lobe Epilepsy, J Epilepsy Res 9(1) (2019) 51-64.
[9] D. Cutuli, E. Landolfo, L. Petrosini, F. Gelfo, Environmental Enrichment Effects on the Brain-Derived Neurotrophic Factor Expression in Healthy Condition, Alzheimer's Disease, and Other Neurodegenerative Disorders, Journal of Alzheimer's disease : JAD 85(3) (2022) 975-992.
[10] L.S. Miller, B. Colella, D. Mikulis, J. Maller, R.E. Green, Environmental enrichment may protect against hippocampal atrophy in the chronic stages of traumatic brain injury, Front Hum Neurosci 7 (2013) 506.
[11] B. Will, R. Galani, C. Kelche, M.R. Rosenzweig, Recovery from brain injury in animals: relative efficacy of environmental enrichment, physical exercise or formal training (1990-2002), Prog Neurobiol 72(3) (2004) 167-82.
[12] E. Cho, K. Kim, H. Kim, S.R. Cho, Reelin protects against pathological α-synuclein accumulation and dopaminergic neurodegeneration after environmental enrichment in Parkinson's disease, Neurobiol Dis 175 (2022) 105898.
[13] D. Young, P.A. Lawlor, P. Leone, M. Dragunow, M.J. During, Environmental enrichment inhibits spontaneous apoptosis, prevents seizures and is neuroprotective, Nature medicine 5(4) (1999) 448-53.
[14] R. Auvergne, C. Lere, B. El Bahh, S. Arthaud, V. Lespinet, A. Rougier, G. Le Gal La Salle, Delayed kindling epileptogenesis and increased neurogenesis in adult rats housed in an enriched environment, Brain research 954(2) (2002) 277-85.
[15] M. Zeraati, N. Najdi, B. Mosaferi, A.A. Salari, Environmental enrichment alters neurobehavioral development following maternal immune activation in mice offspring with epilepsy, Behav Brain Res 399 (2021) 112998.
[16] E. Morelli, V. Ghiglieri, V. Pendolino, V. Bagetta, A. Pignataro, A. Fejtova, C. Costa, M. Ammassari-Teule, E.D. Gundelfinger, B. Picconi, P. Calabresi, Environmental enrichment restores CA1 hippocampal LTP and reduces severity of seizures in epileptic mice, Exp Neurol 261 (2014) 320-7.
[17] G. Dezsi, E. Ozturk, M.R. Salzberg, M. Morris, T.J. O'Brien, N.C. Jones, Environmental enrichment imparts disease-modifying and transgenerational effects on genetically-determined epilepsy and anxiety, Neurobiol Dis 93 (2016) 129-36.
[18] Z. Li, L. Chen, C. Xu, Z. Chen, Y. Wang, Non-invasive sensory neuromodulation in epilepsy: Updates and future perspectives, Neurobiol Dis 179 (2023) 106049.
[19] H. Ye, S. Kaszuba, Inhibitory or excitatory? Optogenetic interrogation of the functional roles of GABAergic interneurons in epileptogenesis, Journal of biomedical science 24(1) (2017) 93.
[20] Y. Lu, C. Zhong, L. Wang, P. Wei, W. He, K. Huang, Y. Zhang, Y. Zhan, G. Feng, L. Wang, Optogenetic dissection of ictal propagation in the hippocampal-entorhinal cortex structures, Nat Commun 7 (2016) 10962.
[21] R.L. Faulkner, M.H. Jang, X.B. Liu, X. Duan, K.A. Sailor, J.Y. Kim, S. Ge, E.G. Jones, G.L. Ming, H. Song, H.J. Cheng, Development of hippocampal mossy fiber synaptic outputs by new neurons in the adult brain, Proc Natl Acad Sci U S A 105(37) (2008) 14157-62.
[22] N. Toni, D.A. Laplagne, C. Zhao, G. Lombardi, C.E. Ribak, F.H. Gage, A.F. Schinder, Neurons born in the adult dentate gyrus form functional synapses with target cells, Nature neuroscience 11(8) (2008) 901-7.
[23] S.G. Temprana, L.A. Mongiat, S.M. Yang, M.F. Trinchero, D.D. Alvarez, E. Kropff, D. Giacomini, N. Beltramone, G.M. Lanuza, A.F. Schinder, Delayed coupling to feedback inhibition during a critical period for the integration of adult-born granule cells, Neuron 85(1) (2015) 116-130.
[24] L.J. Drew, M.A. Kheirbek, V.M. Luna, C.A. Denny, M.A. Cloidt, M.V. Wu, S. Jain, H.E. Scharfman, R. Hen, Activation of local inhibitory circuits in the dentate gyrus by adult-born neurons, Hippocampus 26(6) (2016) 763-78.