在健康的血管中,欧博官网Ang1/Tie2信号通路可通过促进血管内皮细胞的存活和细胞间连接的稳定性来促进血管功能的稳定性[2-5];在视网膜病理状态下,Ang-2和VEGF-A具有协同作用,可致血管功能异常。在病理状态下,如血糖浓度的波动、缺血、缺氧、生长因子及炎症介质等作用下,可发生“Angiogenic switch”,使血管微环境发生改变,Ang-2和VEGF-A表达上调[5-7],Ang-2可与Ang1竞争性结合Tie2,抑制Ang1/Tie2信号通路,这是血管功能异常初始阶段的关键步骤[5-8]。Ang2与Tie2受体结合,可促进新生血管的形成(周细胞凋亡)[9],使血管对VEGF-A敏感;而VEGF-A与Tie2结合,则与血管发生渗漏和新生血管形成有关[7-10]。
此外,Ang2与Tie2受体结合还可诱发白血病和炎症反应用[5,10]。

相关研究进展
基因研究
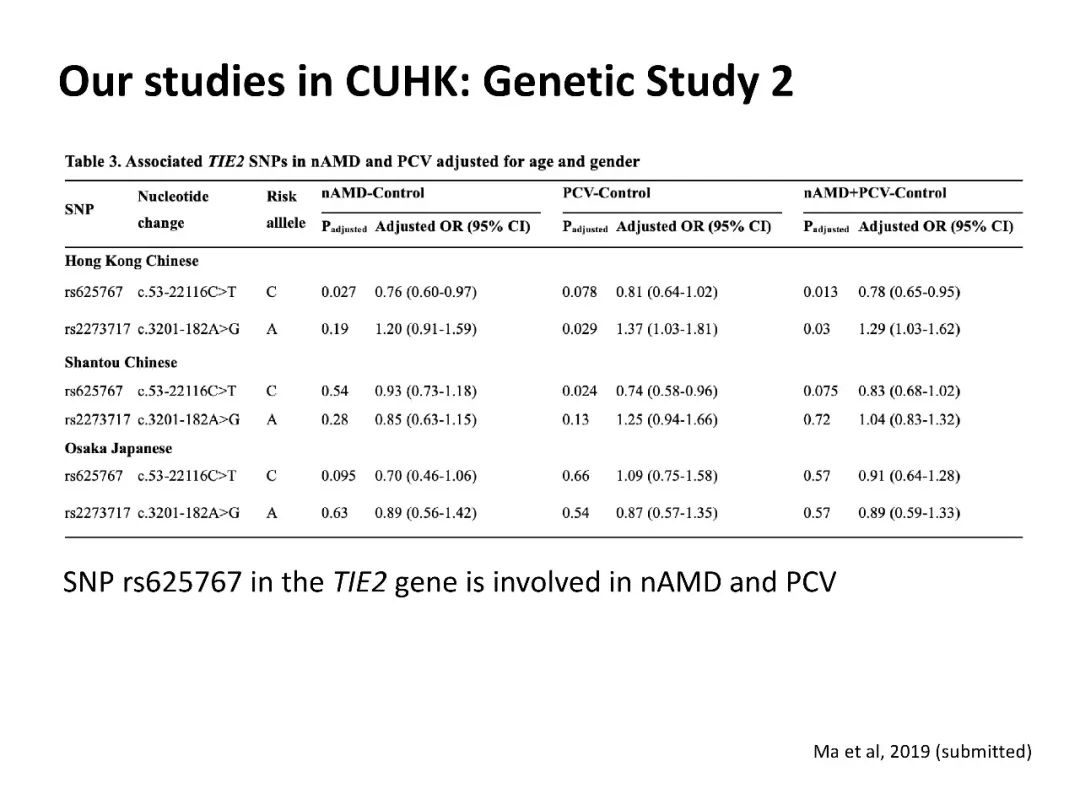
ANGPT2基因有2个SNPs片段与nAMD和PCV高度相关。修正年龄因素后发现,欧博Tie2基因的SNP rs625767 片段与nAMD和PCV相关[11]。

细胞因子相关研究
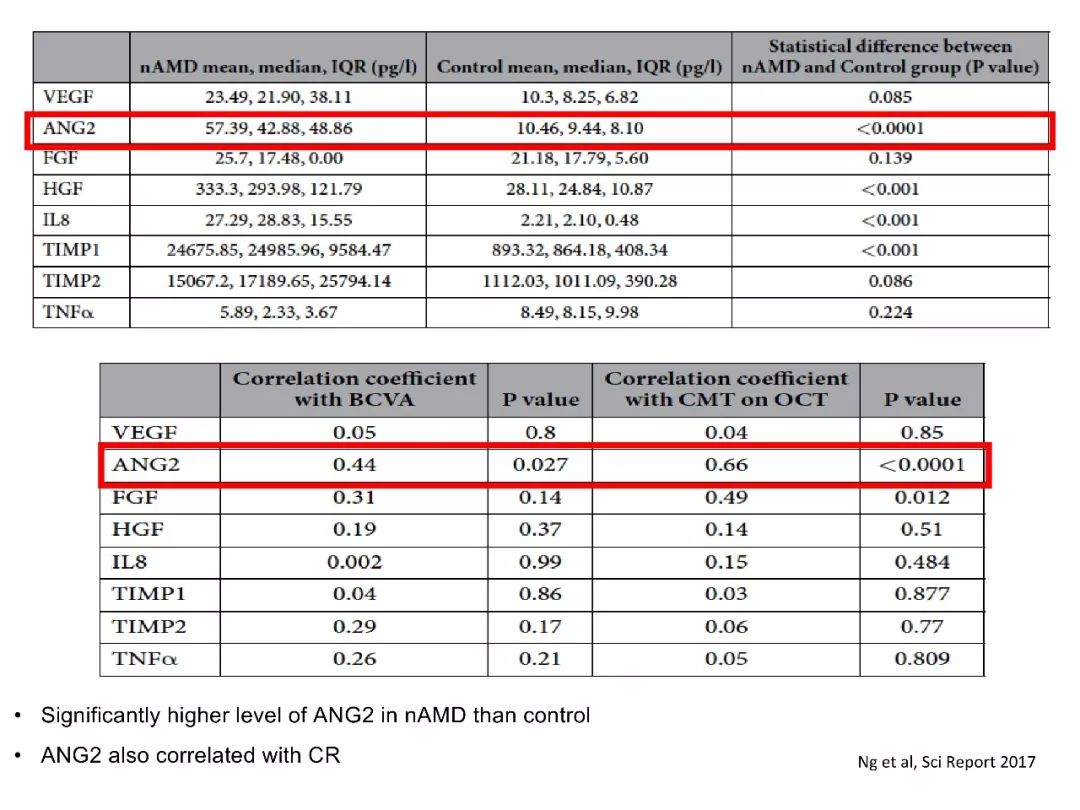
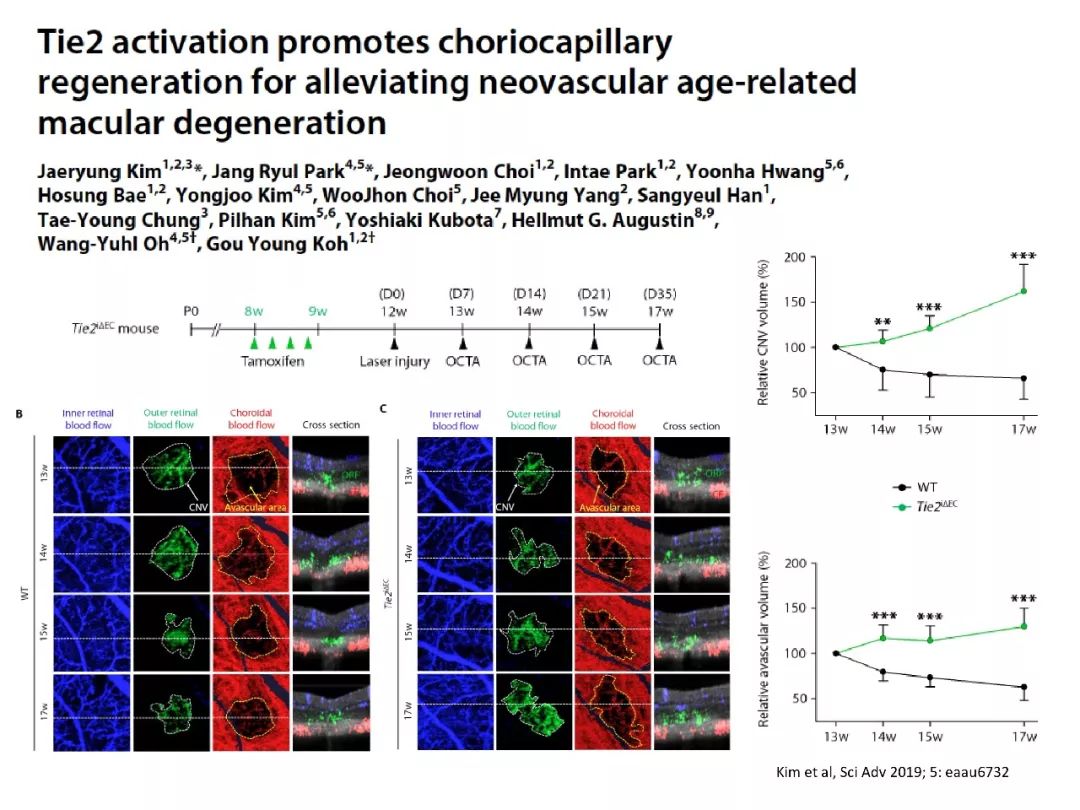
nAMD患者房水中Ang2水平升高,且与黄斑病变严重程度密切相关。与对照组相比,nAMD患者中Ang2的表达水平显著增高。Tie2的激活可促进脉络膜毛细血管再生,从而减轻nAMD的病变[12-13]。

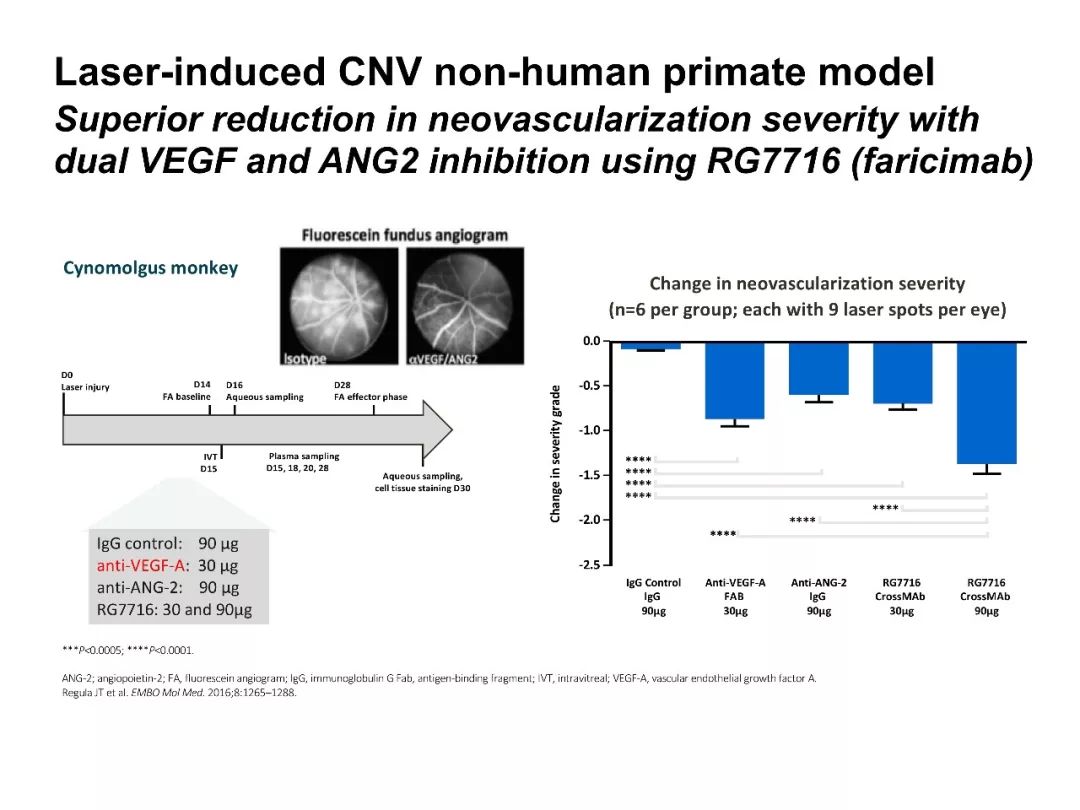
此外,Ang2/Tie2信号通路还与炎症反应相关。视网膜的炎症反应是nAMD和DME的重要病理机制。炎症反应相关的重要事件与血管内皮细胞和血-视网膜屏障(BRB)的通透性改变有关,包括以下情况:炎症因子与内皮细胞的结合;炎症因子扩散至视网膜神经上皮层;炎症因子的释放和血管通透性相关因子的释放等。炎症级联反应过程中的选择性抑制剂,如Ang2抑制剂,有助于提高nAMD的治疗效果[14]。
临床研究
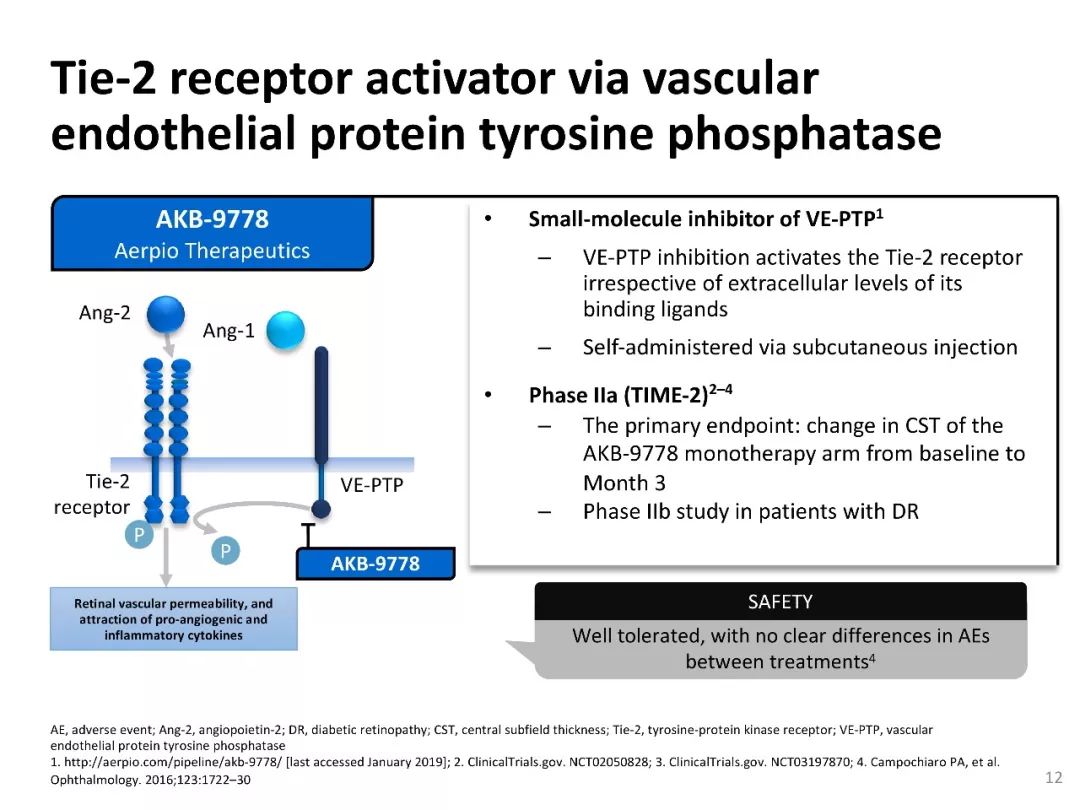
TIME-2研究:VE-PTP小分子抑制剂
VE-PTP小分子抑制剂可激活Tie2受体,与其结合配体的胞外水平无关,可通过皮下注射自行给药。
TIME-2研究[15-18]已进入II期临床试验阶段,研究对象为糖尿病视网膜病变(DR)患者,主要观察终点为黄斑中心凹视网膜厚度(central subfield thickness, CST)的变化,即AKB-9778单药治疗组从治疗基线到治疗后3个月的CST变化。AKB-9778单药治疗组治疗耐受性良好,与对照组相比不良事件发生率无明显差异。
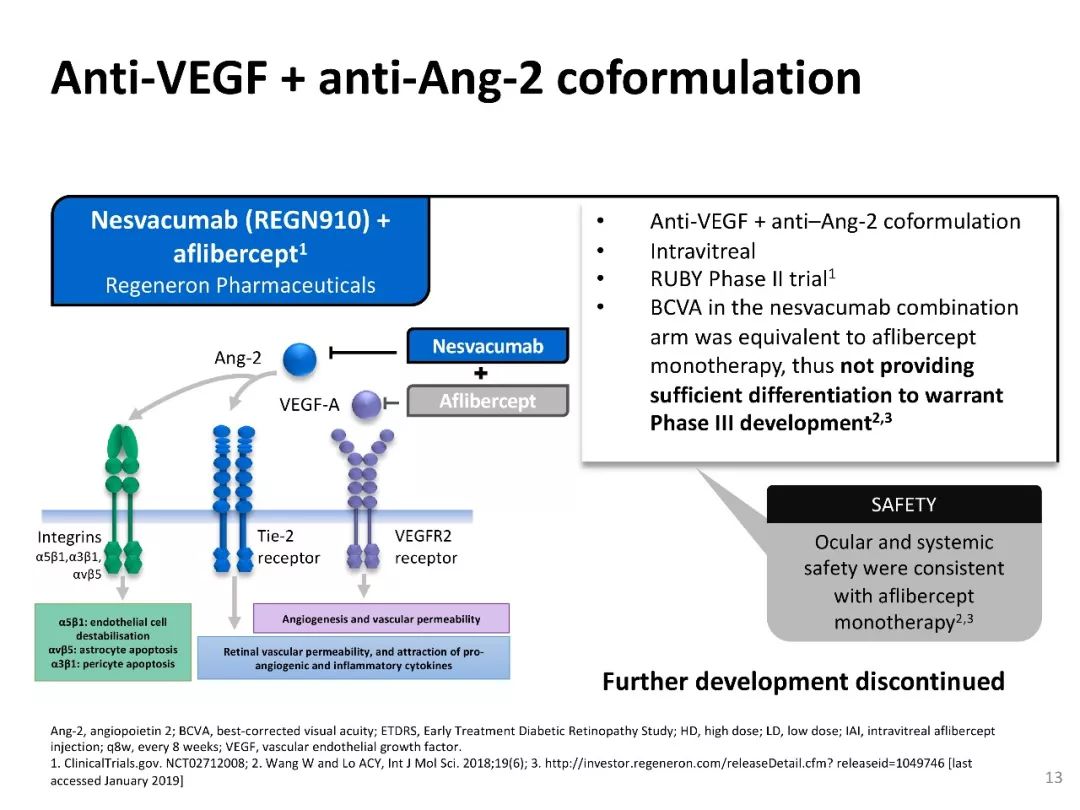
RUBY研究
RUBY[19]研究主要是探索抗VEGF药与抗Ang2药:Nesvacumab(REGN910) +阿柏西普(aflibercept)的联合应用的一项II期临床试验;采用玻璃体腔内注射给药;联合用药组眼部和全身的治疗安全性与阿柏西普单药治疗组一致。联合给药组观察终点的BCVA与阿柏西普单药治疗组相比无明显差异,因此,不足以推进III期临床试验[20,21]。
此外,Ang-2抑制剂在视网膜解剖学(CST)上的改善作用显而易见,提供了Ang-2抑制剂在DME/DR管理中的作用的临床证据。
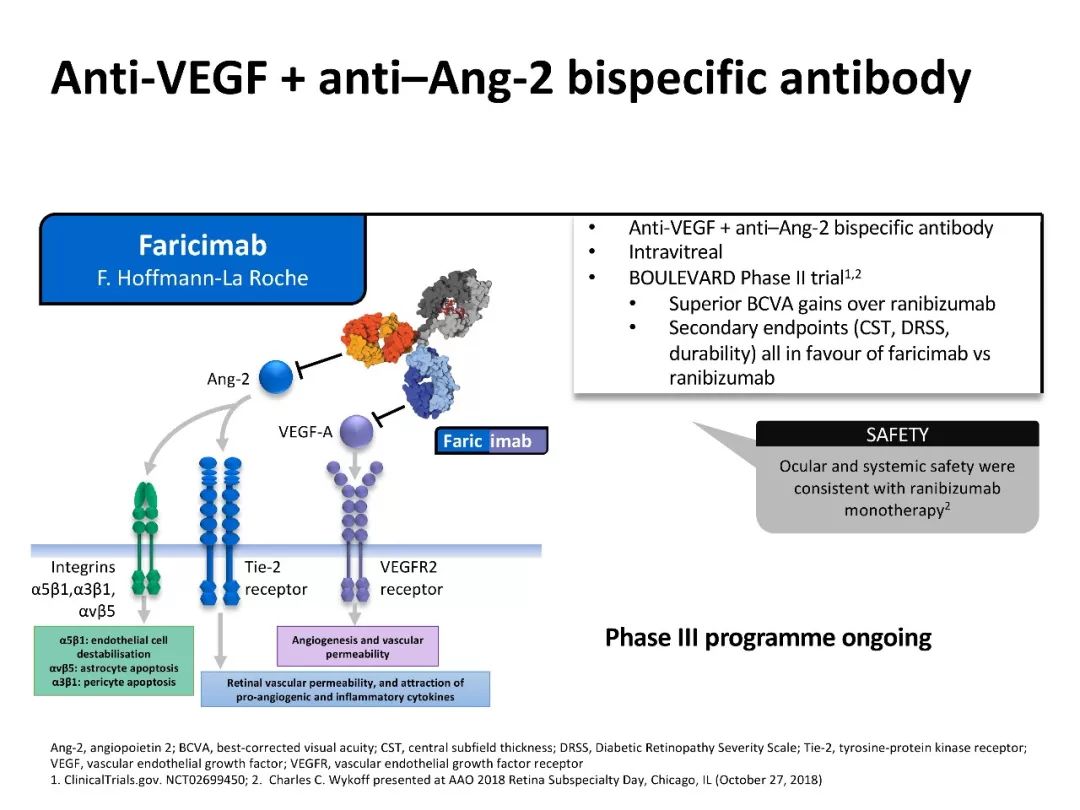
BOULEVARD 研究
BOULEVARD 研究[22,23]为一项抗VEGF与抗Ang-2的双抗体药物faricimab (RG7716)的二期临床试验。
Faricimab具有两个不同的Fab段,可特异性结合并抑制Ang-2和VEGF-A;还有一个Fc段起到去抑制作用,减少炎症反应,因此全身副作用较小。
药物均采用玻璃体腔内注射给药方式。治疗24周后,6.0mg faricimab组BCVA稍高于0.3 mg雷珠单抗组;观察的次级终点包括:黄斑中心凹视网膜厚度(CST)、糖尿病视网膜病变严重程度分级(Diabetic Retinopathy Severity Scale, DRSS)及耐受性等,faricimab组均优于雷珠单抗组。
目前III期临床试验计划开展中。
AVENUE研究和STAIRWAY研究
AVENUE研究和STAIRWAY研究均为关于Faricimab在nAMD治疗中的应用研究。
AVENUE研究结果表明Faricimab有助于改善nAMD患者的CST,并可获得有临床意义的视力提高。
STAIRWAY研究是一项为期52周的、多中心、随机对照研究,分析比较Faricimab 2种延长给药方案(6.0mg,Q12W和Q16W)相对于雷珠单抗(0.5mg,Q4W)的疗效和安全性。在治疗第52周时,与雷珠单抗组相比,Faricimab的Q12W及Q16W治疗组显示出稳定的视力改善结果。

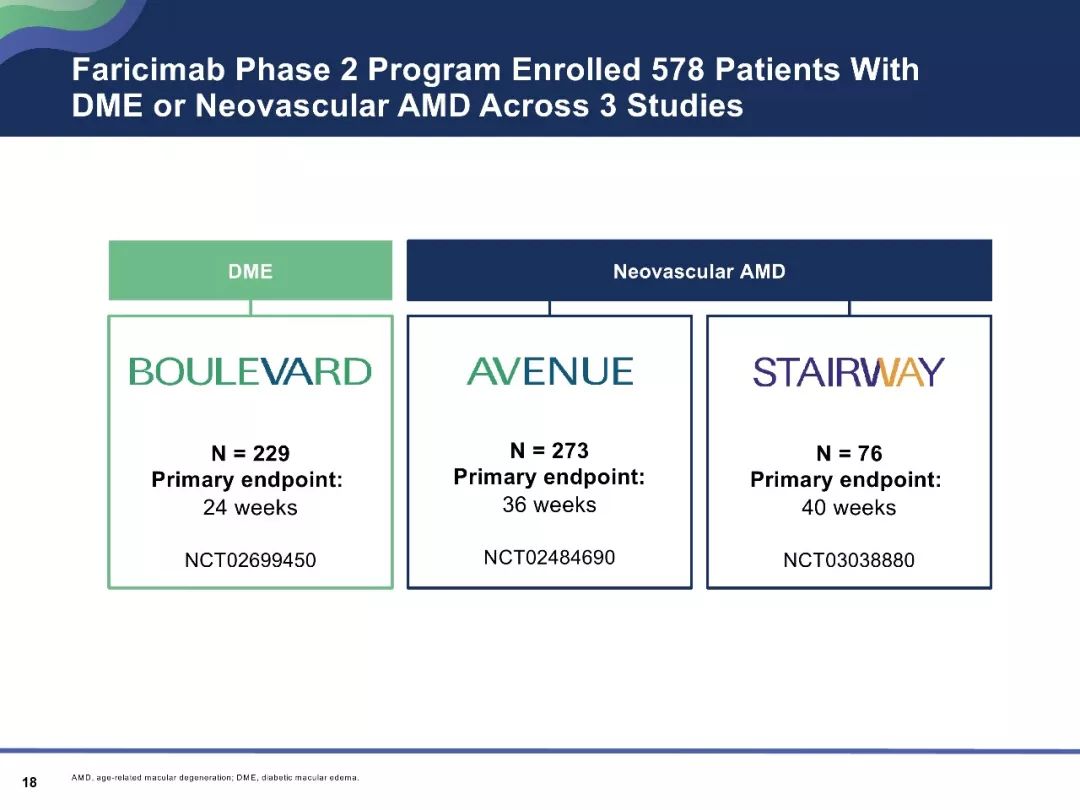
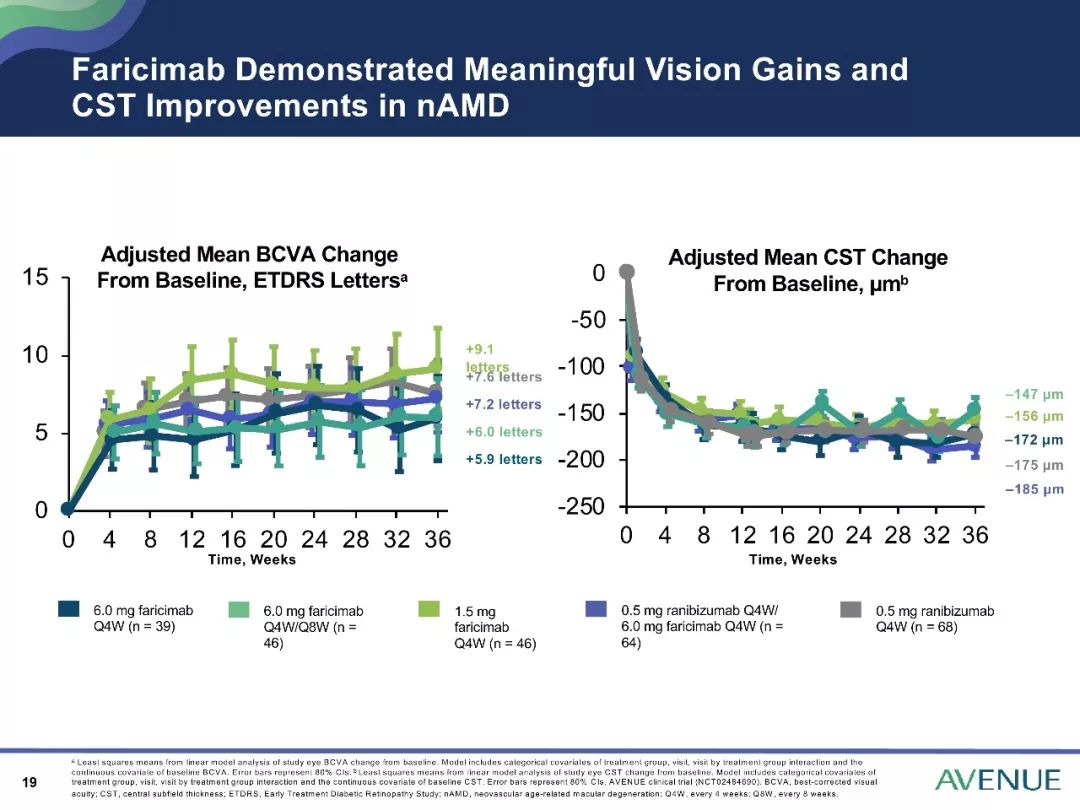
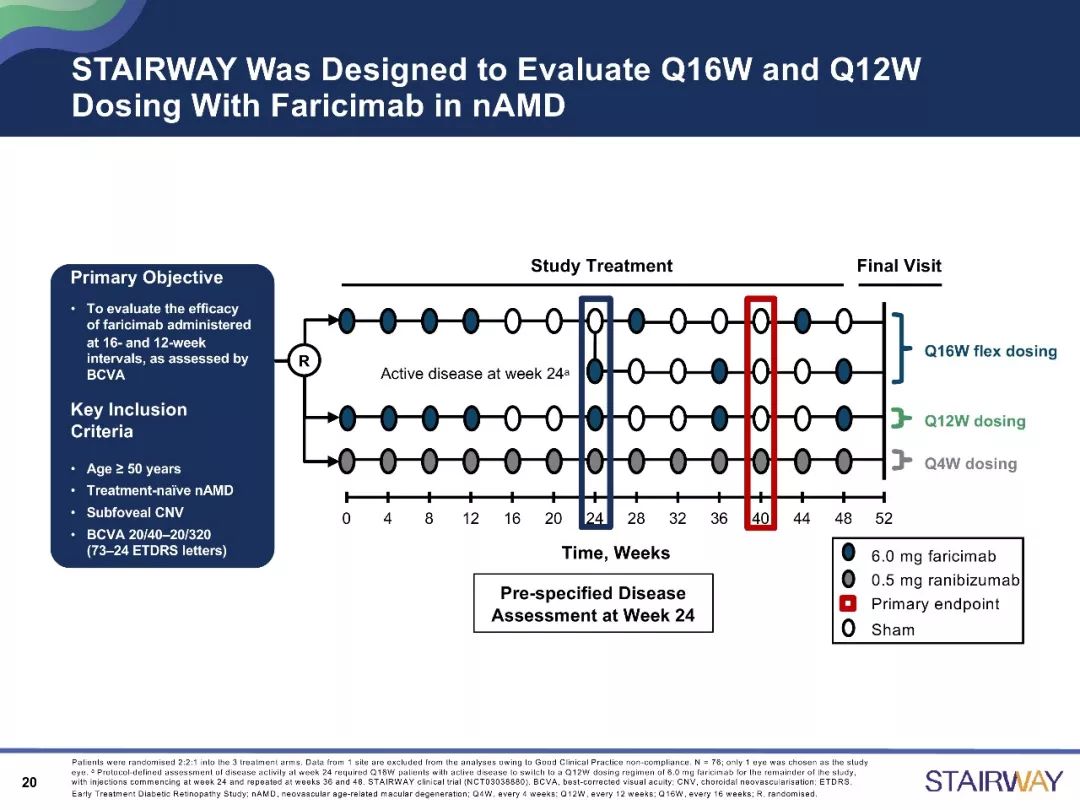
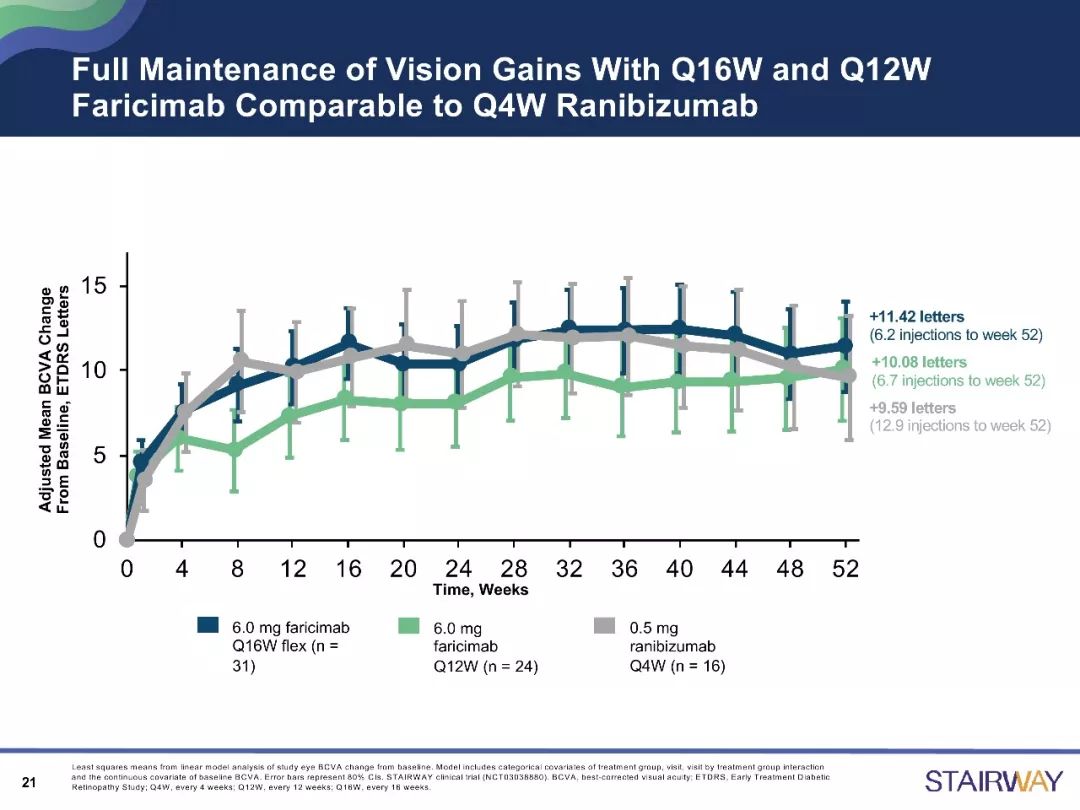
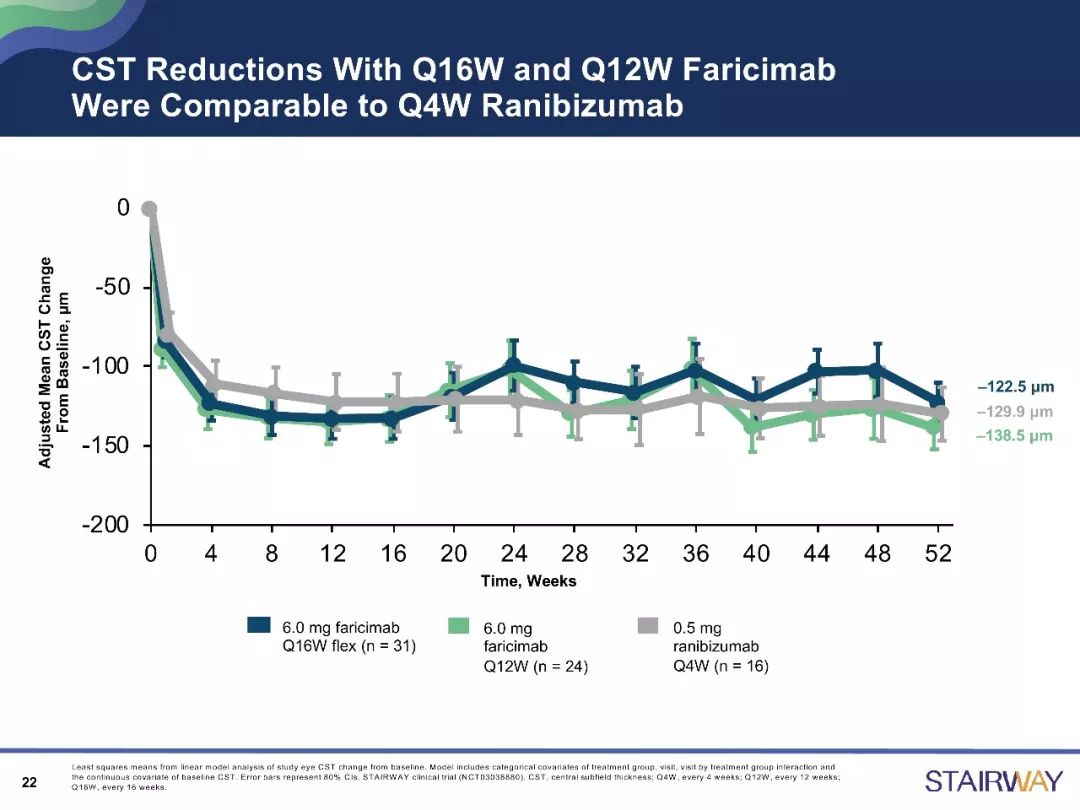
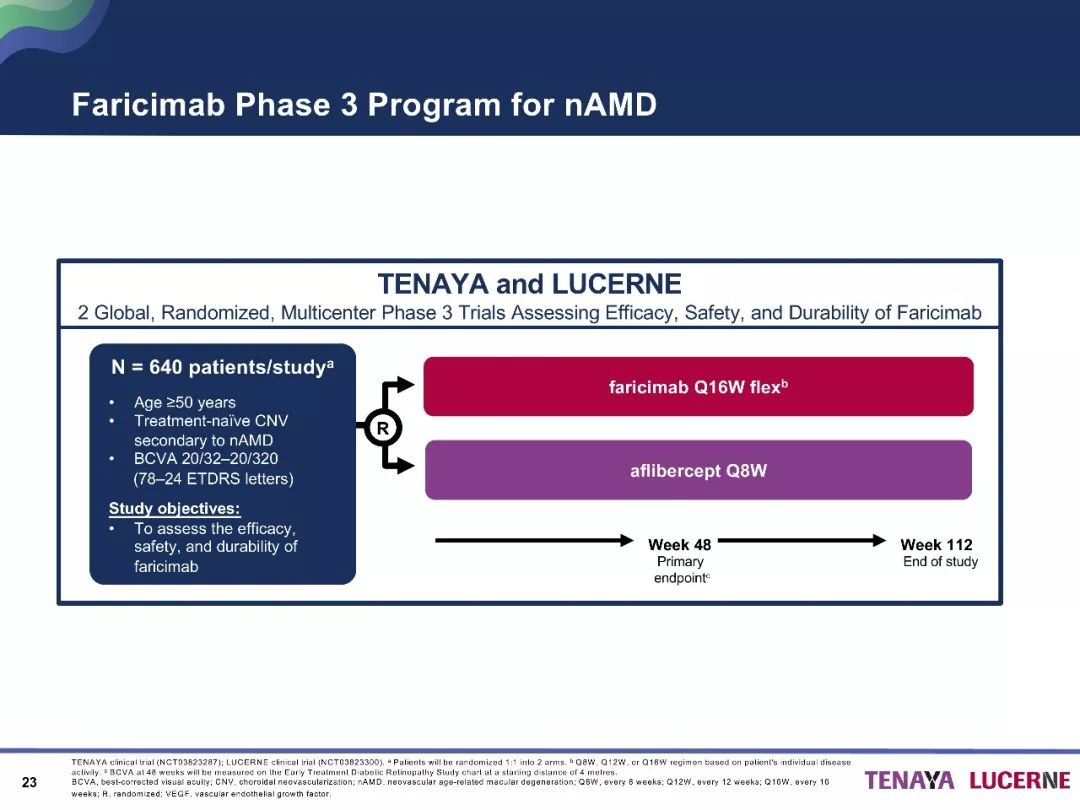
目前,已有关于Faricimab在nAMD治疗中的作用的III期临床试验正在开展,如TENAYA 研究和LUCERNE研究,为全球多中心的研究,主要分析研究其有效性、安全性和耐受性等。
总结
Ang-Tie2信号通路参与血管胚胎发育成熟、血管微环境的平衡稳定和新生血管生成等;
实验室、遗传学和细胞因子等方面的研究表明,Ang-Tie2信号通路与视网膜新生血管性疾病(如nAMD和PCV)的发病机理有关;
Ang-2和VE-PTP是治疗黄斑病变的潜在靶目标;
目前正在进行III期临床试验,以评估抗VEGF与抗Ang-2的双抗体药物在nAMD中的疗效和安全性。
参考文献
1.Campochiaro et al, Prog Retin Eye Res 2015.
2.Nambu H, et al. Gene Ther. 2004;11:865–73.
3.Mueller SB, Kontos CD. J Clin Invest. 2016;126:3188–9.
4.Gamble JR. et al. Circ Res. 2000;87:603–7.
5.Saharinen P, et al. Nat Rev Drug Discov. 2017;16:635–61.
6.Clapp C, et al. Physiol Rev. 2009;89:1177–15.
7.Bolinger MT, et al. Int J Mol Sci. 2016;17:1498.
8.Coxon A, et al. Mol Cancer Ther. 2010;9:2641–51.
9.Klaassen I, et al. Prog Retin Eye Res. 2013;34:19–48.
10.Fiedler U, Augustin HG. Trends Immunol. 2006;27:552–8.
11.Ma et al, IOVS, 2017
12.Ng et al, Sci Report 2017.
13.Kim et al, Sci Adv 2019; 5: eaau6732.
14.H Huang, et al. Nat Rev Cancer. 2010 Aug;10(8):575-85.
15.
16.ClinicalTrials.gov. NCT02050828.
17.ClinicalTrials.gov. NCT03197870.
18.Campochiaro PA, et al. Ophthalmology. 2016;123:1722–30.
19.ClinicalTrials.gov. NCT02712008.
20.Wang W and Lo ACY, Int J Mol Sci. 2018;19(6).
21.?releaseid=1049746.
22. ClinicalTrials.gov. NCT02699450.
23.Charles C. Wykoff presented at AAO 2018 Retina Subspecialty Day, Chicago, IL (October 27, 2018).
专
家
简
介

赖旭佑 Timothy Lai
香港中文大学眼科及视觉科学系荣誉临床教授。香港2010视网膜及黄斑中心主任。作为亚太地区玻璃体视网膜领域权威专家之一,赖教授在国际同行评议索引期刊上发表超过230篇论文、Scopus h指数达46、合作编写、编辑了超过11本教科书。赖教授受邀在世界范围内发表讲演160余次,并获得眼科学界许多国际性奖项,包括亚太眼科学会Nakajima奖、美国眼科学会卓越成就奖、亚太玻璃体视网膜学会Constable奖等。赖教授还在9个国际眼科期刊编委会中任职包括RETINA、Eye、Ophthalmologica等。赖教授也是美国眼科学会、美国视网膜手术医师学会、视网膜学会、黄斑学会的成员。
